1.

|
|
Disponga los tres estados de la materia en orden de desorden molecular creciente.
|
| gaseoso < líquido < sólido |
| gaseoso < sólido < líquido |
| líquido < gaseoso < sólido |
| líquido < sólido < gaseoso |
| sólido < líquido < gaseoso |
| sólido < gaseoso < líquido |
|
2.

|
|
Indique si una sustancia que tiene una masa de 44 g y un volumen de 24.6 L a 27°C es probablemente un gas, un líquido o un sólido.
|
| gas |
| líquido |
| sólido |
| la información es insuficiente |
|
3.

|
|
¿Qué tipos de fuerzas de atracción intermoleculares operan entre las moléculas polares?
|
| de dispersión de London |
| de atracción dipolo-dipolo |
| puentes de hidrógeno |
| de dispersión de London y de atracción dipolo-dipolo |
| de dispersión de London y puentes de hidrógeno |
| de atracción dipolo-dipolo y puentes de hidrógeno |
|
4.

|
|
¿Qué clase de fuerzas de atracción es necesario vencer para sublimar CO2?
|
| de atracción dipolo-dipolo |
| de dispersión de London |
| puentes de hidrógeno |
| todas éstas |
|
5.

|
|
El nitrógeno molecular, N2, , y el monóxido de carbono, CO, son isoelectrónicos y casi iguales en cuanto a masa molecular. Explique por qué el punto de ebullición del CO es un poco más alto que el del N2.
|
| la masa del CO es menor |
| el N2 puede formar puentes de hidrógeno |
| el CO tiene momento dipolar |
| el N2 tiene un momento dipolar más grande |
|
6.

|
|
Identifique los tipos de fuerzas intermoleculares presentes en el C3H8 y el CH3OCH3 y seleccione la sustancia con el punto de ebullición más alto.
|
| C3H8, dispersión; CH3OCH3, dispersión; C3H8, punto de ebullición más alto |
| C3H8, dispersión; CH3OCH3, dispersión, dipolar; C3H8, punto de ebullición más alto |
| C3H8, dispersión, dipolar; CH3OCH3, dispersión, dipolar; C3H8, punto de ebullición más alto |
| C3H8, dispersión; CH3OCH3, dispersión, dipolar; CH3OCH3, punto de ebullición más alto |
| C3H8, dispersión; CH3OCH3, dispersión; CH3OCH3, punto de ebullición más alto |
|
7.

|
|
Racionalice la diferencia de puntos de ebullición entre el CH2BrCl (68°C) y CH3Br (3.5°C).
|
| el CH2BrCl no tiene momento dipolar y el CH3Br no lo tiene |
| CH2BrCl no tiene momento dipolar y el CH3Br sí lo tiene |
| el CH2BrCl es menos polarizable que el CH3Br |
| el CH2BrCl es más polarizable que el CH3Br |
| el CH2BrCl puede formar puentes de hidrógeno |
| el CH2BrCl puede formar puentes de hidrógeno |
|
8.

|
|
El butano y el 2-metilpropano, cuyos modelos de llenado de espacios se muestran en seguida, son ambos no polares y tienen la misma fórmula molecular; sin embargo, el butano tiene un punto de ebullición más alto (-0.5°C en comparación con -11.7°C). Explique a qué se debe esto. 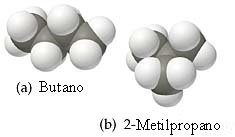
|
| el butano no tiene momento dipolar |
| el 2-metilpropano no tiene momento dipolar |
| sólo el 2-metilpropano puede formar puentes de hidrógeno |
| el butano es menos compacto que el 2-metilpropano |
| el butano es más compacto que el 2-metilpropano |
|
9.

|
|
Identifique la transición de fase que se produce cuando el CO2 sólido se convierte en CO2 gaseoso cuando se calienta.
|
| depositación |
| condensación |
| congelación |
| vaporización |
| sublimación |
|
10.

|
|
El Freón 11, cuya fórmula química es CCl3F, tiene un punto de ebullición normal de 23.8°C. El calor específico delCCl3F(l) y del CCl3F(g) es de 0.87 J/g-K y de 0.59 J/g-K, respectivamente. 24.75 kJ/mol. Calcule el calor necesario para convertir 10.0 g de Freón 11 de un líquido a-50.0°C en un gas a 50.0°C.
|
| 0.15 kJ |
| 0.64 kJ |
| 1.8 kJ |
| 2.5 kJ |
| 2.6 kJ |
|
11.

|
|
Disponga las sustancias siguientes en orden de volatilidad creciente: CH4, CBr4, CH2Cl2, CH3Cl, CHBr3, CH2Br2
|
| CH4 > CBr4 > CH2Cl2 > CH3Cl > CHBr3 > CH2Br2 |
| CH4 > CBr4 > CHBr3 > CH2Br2 > CH2Cl2 > CH3Cl |
| CH4 > CH3Cl > CH2Cl2 > CH2Br2 > CHBr3 > CBr4 |
| CH4 > CH2Br2 > CHBr3 > CBr4 > CH3Cl > CH2Cl2 |
| CH4 > CBr4 > CH3Cl > CH2Cl2 > CH2Br2 > CHBr3 |
|
12.

|
|
¿Cuál es el significado de una línea en un diagrama de fases?
|
| sólo está presente una fase |
| dos fases están en equilibrio |
| tres fases están en equilibrio |
| desaparece la distinción entre dos fases |
|
13.

|
|
El níquel metálico cristaliza en una estructura de empaquetamiento compacto cúbico (celda cúbica centrada en las caras). ¿Cuántos átomos de níquel hay en una celda unitaria?
|
| 1 |
| 2 |
| 4 |
| 8 |
| 9 |
| 14 |
|
14.

|
|
El níquel metálico cristaliza en una estructura de empaquetamiento compacto cúbico (celda cúbica centrada en las caras). ¿Cuál es el número de coordinación de cada átomo de níquel?
|
| 6 |
| 8 |
| 12 |
|
15.

|
|
Un elemento cristaliza en una red cúbica centrada en el cuerpo. La arista de la celda unitaria mide 0.286 nm, y la densidad del cristal es de7.92 g/cm3. Calcule el peso atómico del elemento.
|
| 2.34 x 10-23 g/mol |
| 1.85 x 10-22 g/mol |
| 27.9 g/mol |
| 55.8 g/mol |
| 112 g/mol |
|
16.

|
|
Indique el tipo de cristal (molecular, metálico, de red covalente o iónico) que cada una de las sustancias siguientes formaría al solidificarse: O2, Mo, SiC
|
| O2 -- molecular; Mo -- iónico; SiC -- iónico |
| O2 -- molecular; Mo -- metálico; SiC -- iónico |
| O2 -- molecular; Mo -- metálico; SiC -- de red covalente |
| O2 -- de red covalente; Mo -- metálico; SiC -- iónico |
| O2 -- de red covalente; Mo -- metálico; SiC -- de red covalente |
|
17.

|
|
El punto triple del CO2 está a 5.11 atm y -56.4°C, y el punto crítico está a 73 atm y 31.1°C. ¿Cuál de los enunciados siguientes es incorrecto? 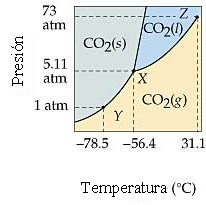
|
| puede existir líquido a presiones menores que 73 atm |
| puede existir sólido por encima de 73 atm |
| la condensación no es posible por encima de 32°C |
| hay sublimación a presiones por debajo de 4 atm |
| no puede haber coexistencia de sólido y gas por encima de 73 atm |
|
18.

|
|
¿Cuál es el número de coordinación en las estructuras de empaquetamiento compacto?
|
| 2 |
| 4 |
| 6 |
| 8 |
| 12 |
|
19.

|
|
¿Cuál de las identificaciones siguientes no es correcta?
|
| H2S -- sólido molecular |
| SiC -- sólido de red covalente |
| KI -- sólido iónico |
| Al -- metálico |
| grafito -- sólido molecular |
|
20.

|
|
¿Cuál de los enunciados siguientes es incorrecto?
|
| las fuerzas de dispersión mantienen unidas las capas del grafito |
| las buckybolas son sólidos moleculares |
| los sólidos de red covalente tridimensional se deforman con facilidad |
| el punto de fusión de un sólido iónico debe depender de la carga de los iones |
| los metales se deforman con facilidad porque los electrones se adaptan sin dificultad a nuevas configuraciones |
|
21.

|
|
¿Cuál de las siguientes no es una característica de un líquido?
|
| no se expande hasta llenar el recipiente |
| es casi incompresible |
| fluye con facilidad |
| la difusión en su interior es rápida |
| adopta la forma del recipiente |
|
22.

|
|
¿Cuál de las sustancias siguientes es la más desordenada?
|
| un gas cerca de la temperatura de condensación |
| un líquido cerca del punto de congelación |
| un sólido cerca del punto de congelación |
| un sólido a una temperatura muy baja |
| un líquido cerca del punto de ebullición |
|
23.

|
|
¿Qué tipos de fuerzas intermoleculares pueden existir entre moléculas neutras?
|
| de atracción dipolo-dipolo |
| interacción iónica |
| de dispersión de London |
| puentes de hidrógeno |
| todas éstas |
| de atracción dipolo-dipolo, de dispersión de London y puentes de hidrógeno |
|
24.

|
|
Prediga el punto de ebullición del H2Se con base en los puntos de ebullición siguientes: H2O – 100°C H2Te – -2°C H2S – -61°C
|
| su punto de ebullición será de alrededor de 10°C |
| su punto de ebullición será de alrededor de 110°C |
| su punto de ebullición será de alrededor de -45°C |
| es imposible estimarlo |
|
25.

|
|
Disponga las sustancias siguientes en orden de punto de ebullición decreciente: N2, O2, NO
|
| N2 > O2 > NO |
| N2 > NO > O2 |
| O2 > N2 > NO |
| NO > N2 > O2 |
| NO > O2 > N2 |
|
26.

|
|
Prediga el orden de los puntos de fusión (del más alto al más bajo) de NH3, CH4, SiH4, y GeH4.
|
| NH3 > CH4 > SiH4 > GeH4 |
| NH3 > SiH4 > CH4 > GeH4 |
| CH4 > SiH4 > GeH4 > NH3 |
| NH3 > GeH4 > SiH4 > CH4 |
| GeH4 > SiH4 > CH4 > NH3 |
|
27.

|
|
¿Por qué el CH(CH3)3 tiene un punto de ebullición más bajo que el C4H10lineal?
|
| no es así; la teoría predice lo contrario |
| el primero tiene un momento dipolar grande |
| el primero es más compacto |
| el primero tiene un peso molecular mayor y más electrones |
| el primero ocupa mucho más espacio que la molécula lineal |
|
28.

|
|
¿Cuáles de las sustancias siguientes probablemente es líquida a temperatura ambiente? | (i) CH4 | (ii) Br2 | (iii) NaCl | (iv) H2O | (v) H2S | (vi) CH3OH |
|
| sólo i y v |
| sólo iv, v y vi |
| sólo iv y vi |
| sólo ii, iv y vi |
| sólo ii, iii, iv y vi |
|
29.

|
|
¿En qué caso o casos no puede haber puentes de hidrógeno entre moléculas similares? | (i) NH3 | (ii)(CH3)2NH | (iii)CH3 O O CH3 CH3 | (iv) NH4+ | (v) CH3COOH |
|
| sólo ii y v |
| sólo iii |
| sólo iv |
| iii y iv |
| sólo iii, iv y v |
|
30.

|
|
Prediga el orden de los puntos de ebullición de las sustancias siguientes: (i)CH3 O O CH3 CH3 | (ii) CH3CH2OH | (iii)CH3CH2NH2 |
|
| i > ii > iii |
| i > iii > ii |
| iii > ii > i |
| ii > iii > i |
| iii > i > ii |
|
31.

|
|
¿Cuál de las siguientes no es una consecuencia de la formación de puentes de hidrógeno en el agua y el hielo?
|
| el hielo es menos denso que el agua |
| el hielo es una estructura abierta con mucho espacio vacío |
| la densidad del agua disminuye cuando se eleva la temperatura un poco por encima del punto de fusión |
| el agua es mala conductora del calor |
| el agua que se congela puede reventar los tubos de plomería |
|
32.

|
|
¿Cuál de las moléculas siguientes interactúa sólo mediante fuerzas dipolo-dipolo? | (i) Ar | (ii) H2O | (iii) HF | (iv) C2H6 | (v) CH3OH |
|
| ii |
| iii |
| v |
| i |
| ninguna de éstas |
|
33.

|
|
¿Cuál o cuáles pares interactúan entre sí sólo por mediante fuerzas dipolo-dipolo y fuerzas de dispersión de London? | (i) H2S, H2O | (ii) H2O, NH3 | (iii) NaCl, H2O | (iv) HCl, CO |
|
| i |
| ii |
| iii |
| iv |
| i y iv |
| i, ii, iv |
|
34.

|
|
¿En qué caso intervienen fuerzas de adhesión?
|
| viscosidad |
| tensión superficial |
| acción capilar |
| puentes de hidrógeno en el agua |
| conductividad térmica |
|
35.

|
|
¿Cuál de los enunciados siguientes es incorrecto?
|
| la entalpía de sublimación es el negativo de la entalpía de depositación |
| la entalpía de vaporización es el negativo de la entalpía de condensación |
| la entalpía de sublimación es mayor que la entalpía de vaporización |
| la entalpía de vaporización es menor que la entalpía de fusión |
| la entalpía de depositación es menor que la entalpía de congelación |
|
36.

|
|
¿Cuál es el cambio de entalpía que se produce cuando 10 g de un líquido a70°C C se convierte en un gas a 100°C? (El líquido hierve a 90°C, los calores específicos son 1.0 J/g-K en el líquido y 0.3 J/g-K en el gas, y la entalpía de vaporización es de 8.5 J/g.)
|
| 230 J |
| 290 J |
| 85 J |
| 320 J |
| 285 J |
|
37.

|
|
El punto crítico se caracteriza por
|
| una temperatura por debajo de la cual no es posible formar un líquido |
| un valor único sólo de presión para cada sustancia |
| un valor único sólo de temperatura para cada sustancia |
| un valor único de temperatura y presión para cada sustancia |
| ser más bajo en cuanto a temperatura cuando las fuerzas intermoleculares son más intensas |
|
38.

|
|
¿Cuál de los enunciados siguientes es incorrecto?
|
| la presión de vapor está determinada por un equilibrio dinámico entre el líquido y el vapor |
| los líquidos volátiles tienen fuerzas intermoleculares relativamente débiles |
| cuando más intensas son las fuerzas intermoleculares, tanto mayor es la presión de vapor |
| la presión de vapor aumenta con la temperatura |
| cuanto mayor es la temperatura, más probable es que una molécula tenga la energía suficiente para escapar a la fase gaseosa |
|
39.

|
|
¿Cuál de las sustancias siguientes tendrá la presión de vapor más grande a una temperatura dada?
|
| C5H10 |
| NaCl |
| CH3COOH |
| C14H30 |
| H2O |
|
40.

|
|
Mencione dos puntos de un diagrama de fases que se caracterizan por un valor único de temperatura y presión.
|
| punto crítico y punto de fusión |
| punto triple y punto de fusión |
| punto de ebullición y punto triple |
| punto de ebullición y punto crítico |
| punto crítico y punto triple |

